溶度積
難溶鹽 BA 與其飽和溶液共存時,存在下列平衡:
BA ( s )![]() B ( aq ) A - ( aq )
B ( aq ) A - ( aq )
其標準平衡常數表達式為:
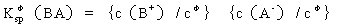
K sp φ 稱為標準溶度積常數,簡稱溶度積。若向難溶鹽 BA 中加水,當 B , A - 離子的濃度之積小于溶度積 K sp φ 時,沉淀溶解;等于溶度積時達到飽和。若將含 B 離子與 A - 離子的溶液混合,其離子濃度的乘積大于溶度積時,超過的部分就變成難溶性鹽 BA 沉淀出來。綜上所述歸納如下:
1 ) {c ( B ) /c φ }{c ( A - ) /c φ } < {K sp φ ( BA ) } 不飽和溶液,無沉淀;
2 ) {c ( B ) /c φ }{c ( A - ) /c φ }={K sp φ ( BA ) } 飽和溶液;
3 ) {c ( B ) /c φ }{c ( A - ) /c φ } > {K sp φ ( BA ) } 沉淀從溶液中析出。以上 3 點就是溶度積規則,用來判斷沉淀的生成與溶解能否發生。
若在難溶鹽 BA 的飽和溶液中,加入同種離子(例如 B 或 A - ),則{ c ( B ) /c φ }{ c ( A - ) /c φ }> {K sp φ ( BA ),剩余離子形成 BA 沉淀下來。難溶鹽的溶解度由于共同離子的存在而減少,稱為同離子效應,即由于同離子效應使溶解平衡向左(生成固體方向)移動:
BA ( s )![]() B ( aq ) A - ( aq )
B ( aq ) A - ( aq )
若在難溶鹽 BA 的飽和溶液中,加入易溶鹽如 KNO 3 , BA 的溶解度增大,這種效應叫做鹽效應。
假如加入的鹽能產生同離子效應,又能產生鹽效應的話,同離子效應大于鹽效應 。
難溶鹽以通式 B x A y 表示,則
B x A y ( s )![]() xB ( aq ) yA - ( aq )
xB ( aq ) yA - ( aq )
K sp φ ( B x A y ) = { c ( B ) /c φ } x { c ( A - ) /c φ } y
北京天優福康生物科技有限公司
官網:http://m.jyzjsd.com/
服務熱線:400-860-6160
聯系電話/微信:13718308763
QQ:2136615612 3317607072
E-mail:Tianyoubzwz@163.com


