細胞鋪板(詳細步驟)
簡介
細胞鋪板是細胞實驗中常見又必須的實驗操作,在細胞計數、培養、免疫熒光等實驗操作中必不可少。主要是根據實驗目的將一定濃度的細胞稀釋液無污染地接種到細胞計數板中,方便進行下一步操作。
用途
用于細胞計數、遷移、侵襲實驗等。
材料與儀器
75% 的酒精、酒精棉球、超凈臺、倒置顯微鏡、酒精燈、移液槍、槍頭、PBS 液、0.25% 胰酶、培養皿、含 5% 血清的新鮮培養基、15 mL 離心管、離心機。
步驟
1、準備工作:實驗前,提前 30 分鐘打開超凈臺,打開水浴鍋,37 ℃ 預熱培養基、PBS 以及胰蛋白酶。紫外照射 30 min 后:
① 75% 的酒精擦拭雙手,同時用酒精棉球擦拭超凈臺;
② 將培養液、實驗所需材料也放入超凈臺進行滅菌(血清、培養基除外);
③ 倒置顯微鏡下,觀察細胞的狀態,是否已經長滿培養瓶,需要進行分瓶。
2、棄去培養基,用槍盡量去培養基。沿無細胞的壁加入 5 mL PBS 液清洗一遍,四個方向晃動倒掉。
3、將 0.25% 胰酶 600 uL 加入培養皿內,上下左右鋪勻,37 ℃ 消化,細胞系大約消化 1 min,原代細胞消化 5 min 左右,隨時觀察,見到細胞泥沙狀留下時,即消化完全。
4、加入 4 mL 的含 5% 血清的新鮮培養基,反復吹打消化好的細胞使其脫壁并分散,制成細胞懸液,然后裝到 15 mL 離心管中。1000 rpm 離心 3 min。
5、棄上清。用 3 mL PBS 洗細胞,吹打混勻,洗 2 次,1000 rpm 離心 3 min,棄上清。
6、細胞沉淀中加 3 mL 5% 血清的新鮮培養基,吹打混勻,即得稀釋過的細胞懸液。
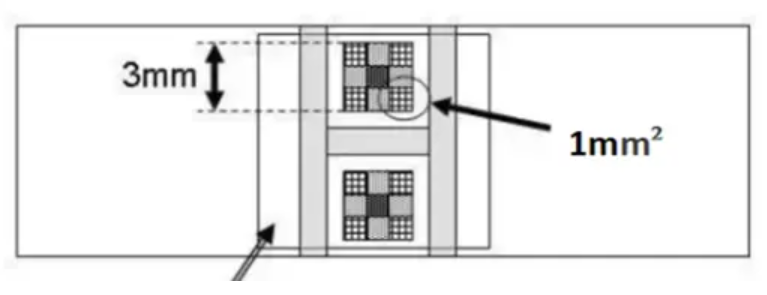
7、移液槍吸取 15 μL 細胞懸液,沿蓋玻片邊緣將細胞懸液緩慢充滿蓋玻片和計數板之間,注意蓋片不要有氣泡。計算四大格細胞計數總數,對于壓線細胞,技術原則為計上不計下,計左不計右。計算公式:細胞數 / mL = 四大格細胞總數 / 4×104。
8、根據鋪板密度,計算稀釋過的細胞懸液用量,剩余體積用細胞稀釋液補。
注意事項
1、細胞板子不需要提前用培養基潤洗,直接從邊上滴入混有細胞的培養基;
2、放置 30 s~1 min 后,前后搖晃 5~8 次;
3、放在水平臺上靜置 2~5 min,后放入孵箱。
4、因為有些細胞刮刀不好用,沒有辦法刮到周圍的,一般在提取蛋白或者提取 RNA 的時候有時會想要鋪中間多,周圍少的板子,手法如下:細胞板子不需要提前潤洗,從中間滴入進去后;然后,把板子朝一個方向順時針或者逆時針旋轉 3~5 圈;再在水平臺上靜置 2~5 min;最后放入孵箱。
5、細胞計數前后出現較大誤差考慮細胞沉降導致懸液不勻;懸液體積過大或過小;稀釋倍數太高或太低等原因造成。
6、盡量將細胞吹打為單個,防止抱團,且用移液槍充分吹打,使其均勻懸浮在培養基中。
7、由于加入計數室的量,過少會導致計數室內出現氣泡,過多則會使得計數板上的蓋玻片不緊貼計數板,使得高度變高,體積變大;計數室體積為 9 mm3,所以一般加 15 uL 左右。
8、計數時,細胞稀釋倍數一般最適濃度為 5~10×105 細胞 / mlL。如一般 10 cm 皿的細胞約 300~500 萬個,一些細胞個體小也能達到 1000~2000 萬,可根據所需細胞數目取出部分作稀釋或連續稀釋后計數。


